Oxigèn
L’oxigèn es un element quimic de simbòl O e de numèro atomic 8. Se situa dins la linha II e dins la colona 16 de la taula periodica. A donc un pes atomic relativament feble (15,999) mai una electronegativitat fòrça importanta (la segonda pus auta). Fa partida dei non metaus e, dins lei condicions normalas de pression e de temperatura, sa forma principala es lo dioxigèn O2. Gasós, constituís 21% dau volum totau de l'atmosfèra terrèstra.
Element frequent dins l'Univèrs, l'oxigèn pòu formar de compausats fòrça variats coma d'oxids e divèrsei substàncias organicas. Tènon un ròtle fòrça important dins lei mecanismes dau vivent, especialament lo dioxigèn, l'aiga e lo dioxid de carbòni.
Istòria
[modificar | Modificar lo còdi]De l'Antiquitat a l'aparicion de la quimia
[modificar | Modificar lo còdi]
Se la descubèrta de l'oxigèn es relativament recenta, d'observacions de sa preséncia ò de sei proprietats aguèron luòc tre l'Antiquitat. La pus anciana coneguda a l'ora d'ara es aquela de Filon de Bizanci (vèrs 280-220 avC) que s'interessèt a la combustion d'una candèla plaçada dins una campana sotada dins d'aiga. Observèt una montada dau nivèu de l'aiga dins la campana mai expliquèt lo fenomèn per una transformacion d'un volum d'aire en element fuòc[1]. Durant la Renaissença, Leonardo da Vinci (1452-1519) repetiguèt aquela experiéncia per la combustion e capitèt de l'estendre a la respiracion.
A la fin dau sègle XVI ò au començament dau sègle XVII, l'alquimista polonés Michael Sendivogius (1566-1636) isolèt una mòstra de dioxigèn gasós mai mau capitèt de d'identificar sa natura. En revènge, observèt una partida de sei proprietats biologicas e li donèt lo nom de cibus vitae. Per aquela rason, Sendivogius es de còps considerat coma lo premier descubraire de l'oxigèn[2].
Dos sègles pus tard, Robert Boyle (1627-1691) demostrèt que l'aire es necessari a la combustion. Puei, totjorn au sègle XVII, lo quimista anglés John Mayow (1641-1679) capitèt d'isolar la partida de l'aire necessària a la combustion e a la respiracion. Estimèt son volum a 20% dau volum totau de l'aire e la diguèt spiritus nitroaereus. Mayow mesurèt tanben l'aumentacion de massa d'una mòstra d'antimòni avans e après sa combustion. Concluguèt que lo spiritus nitroaereus deviá se combinar amb lo metau. Puei, generalizèt aqueu resultat a la respiracion dins un obratge paregut en 1688. Marcant de progrès importants, sa teoria desvolopèt l'idéa d'una extraccion dau spiritus nitroaereus de l'aire per lei paumons, de son transpòrt per lo sang e de sa consumacion dins lei muscles[3].
Lo periòde de la teoria dau flogistic
[modificar | Modificar lo còdi]Durant lei sègles XVII e XVIII, plusors sabents realizèron d'experiéncias entraïnant una produccion importanta de dioxigèn. Entre lei pus famós, se pòdon citar Robert Hooke (1635-1703), Ole Borch (1626-1690), Mikhail Lomonosov (1711-1765) e Pierre Bayen (1725-1798)[4]. Pasmens, foguèron pas capables d'identificar sa descubèrta probablament en causa de la teoria dau flogistic que dominava la quimia d'aqueu temps. D'efiech, aquela teoria explicava la combustion per l'existéncia d'una substància, dicha flogistic, qu'èra perduda quand un materiau èra cremat. L'aire i aviá ges de rótle.
La descubèrta de l'oxigèn
[modificar | Modificar lo còdi]La descubèrta de l'oxigèn es generalament atribuïda au farmacian Carl Wilhelm Scheele (1742-1786). Entre 1771 e 1775, isolèt de dioxigèn gasós a partir d'oxid de mercuri e de nitrats. O diguèt « aire de fuòc ». A respèct de sei predecessors, identifiquèt la natura gasosa dau dioxigèn. Dins aquò, en 1774-1775, lo Britanic Joseph Priestley (1733-1804) realizèt d'experiéncias similaras d'un biais independent e arribèt a la meteissa conclusion[5]. Es ansin de còps creditat de la descubèrta de l'oxigèn car publiquèt sei resultats tre 1775 (contra 1777 per Scheele).
Pus tard, Antoine Lavoisier (1743-1794) proclamèt aver comprés la natura gasosa dau dioxigèn avans lei dos òmes mai aquò es pauc probable. En revènge, gràcias d'experiéncias de combustion pus precisas, capitèt d'identificar l'oxigèn coma element quimic en 1777. Revolucion majora dins l'istòria de la quimia, aquò li permetèt tanben de donar son nom definitiu a l'oxigèn a partir dei mots grècs ὀξύς (« acid » en occitan) e -γενής (« productor »). D'efiech, Lavoisier pensava que l'oxigèn èra lo constituent deis acids en causa de son ròtle dins la corrosion[6]. Aquela error foguèt compresa en 1812 mai èra tròp tard per cambiar de nom.
-
Retrach de Carl Wilhelm Scheele
-
Retrach de Joseph Priestley
-
Retrach d'Antoine Lavoisier
Lo desvolopament deis aplicacions industrialas de l'oxigèn
[modificar | Modificar lo còdi]
Après sa descubèrta, l'oxigèn demorèt un objècte d'estudi important tant per lo desvolopament de la quimia que de l'industria. En particular, mai d'un procès foguèt concebut per produrre de dioxigèn liquid. Lo premier foguèt inventat per lo Soís Raoul Pictet (1846-1929) que mesclèt reaccions quimicas e operacions fisicas per obtenir una pichona quantitat de dioxigèn liquid en 1877[7]. Pasmens, foguèt necessari d'esperar lo trabalh de James Dewar (1842-1923) per de dispausar d'un volum sufisent per realizar de mesuras.
Lo premier procès comerciau foguèt l'òbra de Carl von Linde (1842-1934) e de William Hampson (1854-1926). Basat sus la destillacion d'aire liquefiat a temperatura bassa, permetèt la generalizacion d'aplicacions industrialas coma lo calamèu oxacetilenic.
La descubèrta dei ròtles biologics de l'oxigèn
[modificar | Modificar lo còdi]Coma o mòstra leis experiéncias de Leonardo da Vinci ò Michael Sendivogius, d'indicis dau ròtle de l'oxigèn foguèron observats tre lo periòde de la Renaissença. De mai, a la fin dau sègle XVIII quand l'element oxigèn foguèt descubèrt, la teoria de John Mayow permetiá d'explicar una partida dau foncionament de la respiracion animala.
Aquela dei vegetaus comencèt d'èsser compresa per Joseph Priestley que placèt alternativament una rata e una planta dins una mòstra de dioxigèn. Observèt que la respiracion de la rata « bleçava » lo gas de la mòstra qu'èra « restaurat » per la planta. Tre 1778, Jan Ingenhousz (1730-1799) demostrèt que la lutz solara èra necessària au bòn debanament d'aqueu fenomèn. Enfin, Jean Senebier (1742-1809) concluguèt en 1796 que la respiracion vegetala èra basada sus un procès invèrs a aquela deis animaus. Aquò menèt a la descubèrta de la reaccion de fotosintèsi, tèrme formulat au sègle XIX, qu'es pas encara totalament compresa a l'ora d'ara.
Proprietats quimicas
[modificar | Modificar lo còdi]Proprietats atomicas
[modificar | Modificar lo còdi]L'atòm d'oxigèn a uech electrons que son estat fondamentau es 1s2 2s2 2p6. A donc sièis electrons de valéncia e doas proprietats de remarca :
- una electronegativitat fòrça importanta (3,44 segon l'escala de Pauling) en causa de la preséncia d'interaccions fòrtas entre lo nuclèu e lei sosjaç 2s e 2p.
- la cèrca d'una configuracion electronica establa similara an aquela de neon.
L'oxigèn a donc una reactivitat que presenta de similituds amb leis autreis elements de la colona 16 de la taula periodica mai pòu pas practicar, au contrari d'aqueleis elements, l'ipervaléncia (es a dire plaçar 18 electrons dins sa valéncia per s'estabilizar). En causa d'aqueu limit, sei proprietats quimicas an donc una certana similitud amb aquelei de l'azòt qu'es son vesin dirècte, especialament sa capacitat de crear de liames quimics amb un atòm d'idrogèn. De mai, pòu, coma l'azòt, formar de liames idrogèn.
Ocurréncia e isotòpia
[modificar | Modificar lo còdi]Ocurréncia
[modificar | Modificar lo còdi]Segon lei mesuras espectrograficas realizadas dempuei la Tèrra, l'oxigèn es lo tresen element pus present dins la Via Lactèa. En massa, sembla ansin formar 0,9% dau Soleu, 23,1% de l'atmosfèra de la Tèrra[8], 49,2% de sa crosta e 88,8% de seis oceans[9].
Aquela abondància relativa s'explica per lei mecanismes de fusion nucleara que se debanan au còr deis estelas. D'efiech, quand an agotat sei resèrvas d'idrogèn, leis estelas de tipe solar son capablas d'entraïnar de reaccions de fusion de seis atòms d'èli que menan a la formacion d'oxigèn.
Isotòpia
[modificar | Modificar lo còdi]En 2019, 17 isotòps de l'oxigèn èran estats identificats. Tres son estables. Sus Tèrra, lo pus frequent es l'oxigèn-16 (99,76%) qu'es format per la fusion de l'èli contengut dins lei nuclèus estellars. Pasmens, existís tanben l'oxigèn-17 (0,04%) e l'oxigèn-18 (0,20%). Lo premier es eissit de cicles de fusion dichs cicle CNO que pòdon aver luòc la fusion de l'èli. Lo segond se fòrma a partir de nuclèus d'azòt-14 creats per lei cicles CNO[10].
Leis isotòps instables an de periòdes radioactius fòrça febles (122,24 s per la pus lònga). An pauc d'aplicacions franc de l'oxigèn-15 qu'es utilizat en medecina per realizar de tomografias per emission de positrons.
| Simbòl de l'isotòp |
Z (p) | N (n) | Massa isotopica (u) | Periòde | Mòde(s) de desintegracion |
Isotòp(s)-fiu[11] | Espin nuclear |
|---|---|---|---|---|---|---|---|
| 12O | 8 | 4 | 12,034405(20) | 580(30)×10−24 s [0,40(25) MeV] |
2p (60,0 %) | 10C | 0+ |
| p (40,0 %) | 11N | ||||||
| 13O | 8 | 5 | 13,024812(10) | 8,58(5) ms | β+ (89,1 %) | 13N | (3/2-) |
| β+, p (10,9 %) | 12C | ||||||
| 14O | 8 | 6 | 14,00859625(12) | 70,598(18) s | β+ | 14N | 0+ |
| 15O | 8 | 7 | 15,0030656(5) | 122,24(16) s | β+ | 15N | 1/2- |
| 16O | 8 | 8 | 15,99491461956(16) | Estable | 0+ | ||
| 17O | 8 | 9 | 16,99913170(12) | Estable | 5/2+ | ||
| 18O | 8 | 10 | 17,9991610(7) | Estable | 0+ | ||
| 19O | 8 | 11 | 19,003580(3) | 26,464(9) s | β− | 19F | 5/2+ |
| 20O | 8 | 12 | 20,0040767(12) | 13,51(5) s | β− | 20F | 0+ |
| 21O | 8 | 13 | 21,008656(13) | 3,42(10) s | β− | 21F | (1/2,3/2,5/2)+ |
| 22O | 8 | 14 | 22,00997(6) | 2,25(15) s | β− (78,0 %) | 22F | 0+ |
| β−, n (22,0 %) | 21F | ||||||
| 23O | 8 | 15 | 23,01569(13) | 82(37) ms | β−, n (57,99 %) | 22F | 1/2+# |
| β− (42,0 %) | 21F | ||||||
| 24O | 8 | 16 | 24,02047(25) | 65(5) ms | β−, n (57,99 %) | 23F | 0+ |
| β− (42,01 %) | 24F | ||||||
| 25O | 8 | 17 | 25,02946(28)# | 5,2×10−8s | n | 24O | (3/2+)# |
| 26O | 8 | 18 | 26,03834(28)# | 4,0×10−8 s | β− | 26F | 0+ |
| n | 25O | ||||||
| 27O | 8 | 19 | 27,04826(54)# | < 260 ns | n | 26O | (3/2+)# |
| 28O | 8 | 20 | 28,05781(64)# | < 260 ns | n | 27O | 0+ |
Quimia e proprietats dei compausats oxigenats
[modificar | Modificar lo còdi]En causa de sa reactivitat, l'oxigèn es susceptible de formar de compausats amb mai d'un autre element. Son estat d'oxidacion i es sovent egau a -2 car son electronegativitat auta li permet d'atraire fòrtament leis electrons deis autreis atòms. Pasmens, se tròba tanben l'estat -1 dins lei peroxids e d'estats fòrça rars son estats identificats en certanei moleculas (-1/2, -1/3, +1/2, +1 e +2).
Dioxigèn
[modificar | Modificar lo còdi]Dins lei condicions normalas de temperatura e de pression, lo dioxigèn O2 es la forma pus frequenta de l'oxigèn.
Generalitats
[modificar | Modificar lo còdi]
La molecula de dioxigèn es formada de dos atòms d'oxigèn liats per un liame quimic doble que son energia es relativament febla (498 kJ/mol) per un liame d'aqueu tipe. Conjugada amb una talha pichona (121 pm de longor), aquò li conferís una reactivitat relativament importanta, especialament amb lei materiaus combustibles, que mena generalament a la formacion d'oxids. De mai, explica lo caractèr exotermic de mai d'una reaccion implicant lo dioxigèn.
Au nivèu fisic, es una substància inodòra, incolòra e sensa gòst. Son ponch d'ebullicion se situa a 90,20 K (-182,95 °C) e son ponch de fusion a 54,36 K (-218,79 °C)[12]. Sei formas liquida e solida son blavas.
Ròtle biologic
[modificar | Modificar lo còdi]Dins la biosfèra terrèstra, lo dioxigèn tèn dos ròtles biologics fondamentaus dins lo foncionament dei mecanismes dau vivent. D'efiech, es present tant dins l'atmosfèra que dins lei mitans aqüatics gràcias a sei proprietats de solubilitat dins l'aiga (6,04 mL/L a 25 °C[13]). I participa a la respiracion dei vegetaus e deis animaus. La premiera es liada a la fotosintèsi e vetz la liberacion de dioxigèn per una reaccion permetent ai plantas de produrre de sucre a partir de dioxid de carbòni, d'aiga e de lutz :
- 6 CO2 + 6 H2O + fotons → C6H12O6 + 6 O2
La segonda pertòca la respiracion animala qu'es una reaccion globalament contrària a la fotosintèsi e qu'entraïna la liberacion de dioxid de carbòni e d'energia a partir de dioxigèn e de sucre :
- C6H12O6 + 6 O2 → 6 CO2 + 6 H2O + 2 880 kJ/mol
Ozòn
[modificar | Modificar lo còdi]
L'ozòn (ò trioxigèn) es una substància de formula quimica O3 qu'es formada de tres atòms d'oxigèn. Sa temperatura de liquefaccion es de 161,3 K (−111,9 °C) e sa temperatura de solidificacion de 80,7 K (−192,5 °C). Blau clar a l'estat gasós, es blau sorn sota forma liquida e roge porpre sota forma solida. A una odor similara a l'aiga de javèl e es un gas toxic (CL50 de 8 a 12 mg/m3), corrosiu e comburant[14].
Descubèrt en 1789 per lo quimista olandés Martin van Marum (1750-1837), es naturalament present dins l'atmosfèra terrèstra. I es generalament produch per l'accion de raionaments ultraviolets ò de corrents electrics sus de moleculas de dioxigèn. Sa concentracion es maximala entre 20 e 40 km d'altitud onte forma un jaç protector còntra lo raionament solar. Pasmens, existís d'autrei procès de formacion implicant de polluents eissits de la combustion de carburants fossils. Relativament instable, l'ozòn a una durada d'existéncia febla e se descompausa per tornar formar de dioxigèn.
Dins l'industria, l'ozòn es utilizat per sei proprietats oxidantas e desinfectantas, especialament per produrre d'aiga potabla e per tractar d'aigas corrumpudas. Dins aqueu domeni, son instabilitat es un avantatge important car laissa pas de traças de produchs de tractament dins l'aiga. D'utilizacions segondàrias existisson en medecina (coma desinfectant), en bugadariá, en papetariá (coma agent de blanquiment) e en quimia (dins certanei sintèsis).
Tetraoxigèn
[modificar | Modificar lo còdi]Lo tetraoxigèn es una espècia quimica de formula O4 qu'es compausada de quatre atòms d'oxigèn. Suggerida en 1924 per explicar certanei proprietats dau dioxigèn liquid, son existéncia foguèt confiermada per d'observacions realizadas entre 1999 e 2006. Es una molecula instabla que sa formacion necessita de pressions d'au mens 20 GPa. Son estructura es encara mau determinada.
Aiga
[modificar | Modificar lo còdi]
L'aiga es una substància quimica constituïda de dos atòms d'idrogèn e d'un atòm d'oxigèn. Sus Tèrra, es presenta sota sei tres formas (solida, liquida e gasosa) car sei ponchs de solidificacion e de vaporizacion son respectivament de 0 °C e de 100 °C. Relativament estable, presenta pasmens una reactivitat importanta e es egalament un bòn solvent per lei compausats polars. Es tanben susceptibla de formar aisament de liames idrogèn[15].
L'aiga es una substància indispensabla a la vida terrèstra. D'efiech, es lo constituent majoritari de la màger part deis espècias conegudas amb un percentatge massic mejan de 60% en leis animaus e de 75% en lei vegetaus[16][17].
Leis utilizacions e aplicacions de l'aiga son innombrablas en causa de sei proprietats fisicoquimicas e biologicas. La pus importanta es son utilizacion coma bevenda tant que per leis umans que per leis animaus domestics. Es tanben força utilizada per leis agricultors qu'an besonh d'aigatge. Enfin, a mai d'un usatge dins la vida vidanta e dins l'industria onte pòu servir de reactiu, de solvent, de liquid de refrejament... etc.
Dioxid de carbòni
[modificar | Modificar lo còdi]
Lo dioxid de carbòni es una espècia quimica de formula CO2 qu'es compausada d'un atòm de carbòni e de dos atòms d'oxigèn. Dins lei condicions atmosfericas terrèstras, a ges de fasa liquida. Sa temperatura de sublimacion es de −78,48 °C (194,7 K). Inodòr e incolòr, a una savor cosenta. Au contrari d'una opinion populara frequenta, sa toxicitat es nulla mai, coma totei lei gas, pòu causar d'asfixias en l'abséncia de dioxigèn[18].
Lo dioxid de carbòni a un ròtle biologic important qu'es consumat per lei plantas per produrre sa biomassa a partir de la fotosintèsi e qu'es regitat per leis animaus. De mai, sa preséncia dins l'atmosfèra congrea un efiech de sèrra que permet de la rescaufar en aumentant sa temperatura. Dins aquò, dempuei lo sègle XIX e la consumacion generalizada de combustibles fossils, sa concentracion es venguda tròp importanta entraïnant una aumentacion de la temperatura globala (rescaufament climatic).
Dins l'industria, es subretot utilizat per la produccion d'engrais e per l'industria petroliera afin de facilitar l'esplecha de jaciments d'idrocarburs. Leis aplicacions segondàrias son fòrça variadas. Sota forma gasosa, lo dioxid de carbòni pòu èsser utilizat en agricultura per favorizar la creissença dei plantas ò en seguretat coma agent d'extincion dei fuòcs. Sa forma liquida pòu èsser utilizada coma caloportaire e sa forma solida pòu servir de refrigerant. Enfin, dins son estat supercritic, es utilizat coma agent d'extraccion en quimia (per exemple, per descafeïnar lo cafè).
Oxids
[modificar | Modificar lo còdi]
Un oxid es un compausat associant l'oxigèn amb un element mens electronegatiu. Lo nombre d'oxidacion de l'oxigèn i es egau a -2. Son de substàncias força frequentas a la superficia terrèstra. Per exemple, es lo cas d'un nombre important de mineraus coma lo corindon (oxid d'alumini Al2O3) ò lo qüars (dioxid de silici SiO2). L'aiga e lo dioxid de carbòni, compausats primordiaus dei mecanismes dau vivent, son pereu d'oxids.
Una proprietat de remarca deis oxids es sa capacitat de reagir amb l'aiga per formar d'acids. La quimia deis oxids es pron reducha. D'efiech, sa preparacion es relativament aisada car necessita sovent de grasilhar una substància en preséncia d'aire. De tractaments quimics ulteriors son possibles per eliminar d'impuretats. Pasmens, lo problema per lei quimistas es generalament pas de fabricar d'oxids mai d'asssegurar sa transformacion. En particular, aquela question es centrala dins lei procès de metallurgia destinats a produrre de metaus purs.
Leis utilizacions deis oxids son variadas en causa de sa gròssa diversitat. Pasmens, es possible de destriar dos ensems. Dins lo premier, se tròban leis oxids aguent de proprietats materialas interessentas (materiaus de construccion, semiconductors, catalizaires quimics...). Lo segond gropa leis oxids servissent de reactius ò d'intermediaris dins de procès quimics (preparacion de metaus, sintèsi organica...).
Compausats organics
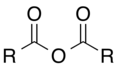
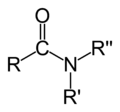
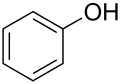
[modificar | Modificar lo còdi]L'oxigèn es un element força present dins lei compausats organics. Entre lei pus importants, se pòdon citar leis alcòls R–OH, leis aldeïds R–CO–H, lei cetonas R–CO–R, leis acids carboxilics R–COOH, leis estèrs R–COO–R, leis anidrids d'acid R–CO–O–CO–R e leis amids R–C(O)–NR2. Divèrsei solvents organics contènon tanben d'oxigèn coma lo fenòl, lo DMF ò lo DMSO.
Produccion
[modificar | Modificar lo còdi]La produccion d'oxigèn se fa sota la forma de dioxigèn. Plusors procès existisson segon lei besonhs e lei luòcs. Lei metòdes industriaus principaus son :
- la destillacion d'aire liquefiat que permet d'evaporar de diazòt gasós e de gardar de dioxigèn liquid.
- l'adsorpcion per inversion de pression que permet de separar lo diazòt e lo dioxigèn de l'aire gràcias a de modificacion de pression e de cambis amb de zeolits.
L'electrolisi de l'aiga es pereu un mejan d'obtenir de dioxigèn. Per aquò, es necessari d'utilizar un corrent continú que permet de recuperar de dioxigèn a un electròde e de diidrogèn a l'autre[19]. Es possible de melhorar lo procès en realizant l'electrolisi de mesclas d'oxids e d'oxoacids.
Enfin, de dispositius son estats concebuts per produrre de dioxigèn dins de situacions d'urgéncia (sosmarins en dificultat, minaires blocats per un afondrament...). Son basats sus de reaccions de descomposicion de superoxids coma lo clorat de sòdi NaClO3, lo peroxid de bari BaO2 e lo perclorat de potassi KClO4.
Liames intèrnes
[modificar | Modificar lo còdi]Bibliografia
[modificar | Modificar lo còdi]- (en) Gerhard A. Cook e Carol M. Lauer, "Oxygen" dins The Encyclopedia of the Chemical Elements, Reinhold Book Corporation, 1968, pp. 499-512.
- (en) John Emsley, "Oxygen", Nature's Building Blocks: An A-Z Guide to the Elements, Oxford University Press, 2001, pp. 297–304.
- (en) Peter H. Raven, Ray F. Evert e Susan E. Eichhorn, Biology of Plants (7th ed.), W. H. Freeman and Company Publishers, 2005, pp. 115-127.
Nòtas e referéncias
[modificar | Modificar lo còdi]- ↑ (en) Joseph Jastrow, Story of Human Error, Ayer Publishing, 1936, p. 171.
- ↑ (fr) Didier Kahn, « Le Tractatus de sulphure de Michaël Sendivogius (1616), une alchimie entre philosophie naturelle et mystique », dins Claude Thomasset (éd.), L’Écriture du texte scientifique au Moyen Âge, Presses de l’Université de Paris-Sorbonne, 2006, pp. 193-221.
- ↑ (en) Gale Thomson, World of Chemistry contributors, article "John Mayow", 2005.
- ↑ (en) John Emsley, "Oxygen", Nature's Building Blocks: An A-Z Guide to the Elements, Oxford University Press, p. 299.
- ↑ Diguèt lo gas novèu « aire deflogisticat ».
- ↑ (fr) Antoine Lavoisier, Traité élémentaire de chimie, edicion de 1864, p. 48.
- ↑ (en) Daintith, John, Biographical Encyclopedia of Scientists, CRC Press, 1994, p. 707.
- ↑ L'abondància de l'oxigèn dins l'atmosfèra de la Tèrra es una particularitat liada a la preséncia d'una biosfèra activa. Per exemple, l'atmosfèra de Mart ne'n contèn que 0,1%.
- ↑ (en) Gerhard A. Cook, Carol M. Lauer, The Encyclopedia of the Chemical Elements, article "Oxygen", Reinhold Book Corporation, 1968, p. 500.
- ↑ (en) B. S. Meyer, Nucleosynthesis and Galactic Chemical Evolution of the Isotopes of Oxygen, dins Workgroup on Oxygen in the Earliest Solar System, Proceedings of the NASA Cosmochemistry Program and the Lunar and Planetary Institute, Gatlinburg, 2005.
- ↑ Isotòps estables en gras.
- ↑ (en) David R. Lide, "Section 4, Properties of the Elements and Inorganic Compounds; Melting, boiling, and critical temperatures of the elements", CRC Handbook of Chemistry and Physics (84th ed.), CRC Press, 2003.
- ↑ Aquela valor aumenta quand la temperatura demenís.
- ↑ (fr) INRS, Fiche toxicologique n°43 « Ozone », consultada lo 23 de genier de 2020, [1]
- ↑ (en) W. L. Jorgensen e J. D. Madura, "Temperature and size dependence for Monte Carlo simulations of TIP4P water", Mol. Phys., 1985, 56 (6): 1381.
- ↑ Dins aquò, de formas de vida existisson onte l'aiga es un constituent minoritari. Per exemple, es lo cas dei granas que ne'n contènon generalament 10%.
- ↑ En l'òme, lo taus mejan es de 65% per un individu adult.
- ↑ (fr) INRS, Fiche toxicologique n°238 « Dioxyde de carbone », consultada lo 22 de genier de 2020, [2]
- ↑ Un corrent alternatiu entraïna la formacion d'una mescla força explosiva de diidrogèn e de dioxigèn.