Alcòl

Un alcòl (var. alcoòl, arcòl, tressièis[1]) es un compausat quimic organic caracterizat per la preséncia d'un atòm de carbòni tetraedric portaire d'un grop idroxil –OH[2]. A l'origina, lo tèrme designava unicament l'etanòl qu'es conegut per l'umanitat dempuei la fin de la Preïstòria. Pasmens, pauc a pauc, d'autreis alcòls foguèron descubèrts e lo grop fòrma uei una familha importanta de compausats organics amb d'aplicacions importantas coma solvents, reactius, combustibles e antigèus.
Istòria[modificar | Modificar lo còdi]
De la Preïstòria a l'aparicion de la quimia modèrna[modificar | Modificar lo còdi]
Leis alcòls, especialament l'etanòl, son probablament coneguts per l'èsser uman dempuei la fin de la Preïstòria. D'efiech, de traças indican una domesticacion de la vinha vèrs 5 000 avC en Caucàs. D'autreis elements, sovent pus ancians (entre 8 000 avC e 5 000 avC), semblan tanben indicar la conoissença dei proprietats de certanei fruchs fermentats en Asia Occidentala, en China e dins lo nòrd-oèst dau continent american[3]. En Egipte, una solucion a basa de metanòl obtengut per pirolisi de la fusta èra utilizat durant lo procès de momificacion.
Lo premier isolament d'etanòl foguèt probablament l'òbra deis alquimistas arabs de l'Edat Mejana. Gràcias a un melhorament dei tecnicas de destillacion, foguèron capables de separar divèrsei compausants dau vin. Aquelei descubèrtas se difusèron en Euròpa – ò redescubèrtas[4] – au sègle XII, principalament per Ramon Llull (1232-1315) que foguèt lo premier de mencionar la diferéncia entre l'alcòl absolut e lei mesclas d'alcòl e d'aiga[5]. Dins aquò, lei progrès foguèron lents e limitats maugrat la redescubèrta dau metanòl per Robert Boyle (1627-1691) en 1661[6].
La comprenença deis alcòls dempuei lo sègle XIX[modificar | Modificar lo còdi]
Amb l'aparicion de la quimia a la fin dau sègle XVIII e au començament dau sègle XIX, lei trabalhs sus leis alcòls conoguèron un desvolopament important. Inicialament fòrça centrats sus l'etanòl, permetèron de'n determinar lei constituents (carbòni, oxigèn, idrogèn) gràcias ai recèrcas d'Antoine Lavoisier (1743-1794). Puei, en 1808, Nicolas Théodore de Saussure (1767-1845) capitèt d'identificar la formula bruta de sa molecula e, en 1858, l'Escocés Archibald Scott Couper (1831-1892) trobèt son estructura[7]. Durant aqueu periòde, lo metanòl foguèt tanben l'objècte de recèrcas que permetèron d'establir son estructura en 1834. Pasmens, pauc a pauc, l'interès se portèt sus l'ensemble deis alcòls amb l'identificacion de la seria omològa deis alcòls linears e aquela deis alcòls segondaris e terciaris (coma lo 2-metilpropan-2-òl).
A partir de la segonda mitat dau sègle XIX, lei progrès dei quimistas entraïnèron l'estudi de fenomèns pus globaus coma de reaccions quimicas d'un tipe donat. Pauc a pauc identificats coma una familha distinta, leis alcòls foguèron integrats dins aqueu movement. Ansin, mai d'una descubèrta en quimia organica aguèt de consequéncias sus la conoissença dei proprietats deis alcòls. En particular, foguèt lo cas de l'estudi de l'esterificacion (fabricacion d'un estèr a partir d'un alcòl e d'un acid carboxilic) per Emil Fischer (1852-1919), deis organomagnesians (que pòdon reagir amb leis alcòls) per Victor Grignard (1871-1935) ò dei reaccions de substitucion nucleofila e d'eliminacion (que pòdon implicar d'alcòls) per Christopher Kelk Ingold (1893-1970)[8][9]. Aquel esfòrç contunièt après la Segonda Guèrra Mondiala amb la descubèrta dau procès Ziegler, per Karl Ziegler (1898-1972), que permet la fabricacion d'alcòls linears a partir d'una reaccion entre l'etilèn e lo trietilalumini[10][11].
Classificacion e nomenclatura[modificar | Modificar lo còdi]
Etimologia[modificar | Modificar lo còdi]
Lo mot « alcòl » vèn de l'arabi Al- e kohl[12]. Lo premier es un article definit e lo segond designava una pouvera obtenguda a partir de la sublimacion de l'estibina. Èra considerada coma « l'esperit » dau minerau e foguèt utilizada coma antiseptic, linhador e cosmetic[13]. Amb lei progrès de l'alquimia araba, la significacion dau tèrme foguèt estenduda a totei lei substàncias destilladas. Puei, son sens se limitèt a l'etanòl quand lei beures alcoolizats foguèron associats a l'idèa « d'esperits ».
Tipes d'alcòls[modificar | Modificar lo còdi]
D'un biais generau, un alcòl contèn la sequéncia R–O–H amb R un radicau organic variable contenent un atòm de carbòni portant lo grop alcòl –OH. Segon sa natura, se destrian[14] :
- leis alcòls primaris onte lo carbòni portant lo grop alcòl es liat a au mens dos atòms d'idrogèn e un radicau organic R.
- leis alcòls segondaris onte lo carbòni portant lo grop alcòl es liat a un atòm d'idrogèn e a dos radicaus organics R e R'.
- leis alcòls terciaris onte lo carbòni portant lo grop alcòl es liat a tres radicaus organics R, R' e R".
Lei fenòls son de còps considerats coma d'alcòls particulars amb un carbòni liat a un cicle benzenic. Pasmens, coma lor reactivitat es ben diferenta d'aquela deis autreis alcòls, son generalament classats en defòra deis alcòls[15].
Leis enòls son egalament de còps considerats coma un cas particular d'alcòls. Son un ensemble de moleculas onte lo carbòni portant la foncion alcòl fa partida d'un liame doble C=C. Dins aquò, es en realitat una forma tautomèra d'un aldeïd e d'una cetona. La forma majoritària i es donc generalament l'aldeïd ò la cetona levat de quauquei cas rars onte l'enòl es estabilizat per mesomeria coma un fenòl[15].
-
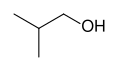
Propan-1-òl, exemple d'alcòl primari
-
Isobutanòl, autre exemple d'alcòl primari
-
Propan-2-òl, exemple d'alcòl segondari
-
Cicloexanòl, autre exemple d'alcòl segondari
-
2-metilbutan-2-òl, exemple d'alcòl terciari
Nomenclatura[modificar | Modificar lo còdi]
Lei règlas de nomenclatura deis alcòls son definidas per l'Union Internacionala de Quimia Pura e Aplicada (IUPAC). Distinguisson dos cas principaus. Quand l'alcòl es la foncion principala, lo nom dau compausat es obtengut en apondent lo sufix « -òl » au nom de l'alcan correspondent e en indicant lo numerò de l'atòm de carbòni liat a la foncion alcòl. Pasmens, es possible d'ometre lo numerò s'aquela informacion es pas necessària a la descripcion[16]. Quand l'alcòl es pas la foncion principala, fau ajustar lo prefix « idroxi- » precedit per lo numerò dau carbòni portant lo grop alcòl[17].
Per la basa conjugada d'un alcòl, lo nom de l'ion alcoolat es format en apondent lo sufix « -oolat ».
-
Metanòl, exemple d'alcòl onte la chifra dau nom pòu èsser omesa en causa de sa simplicitat
-
Propan-1,2,3-triòl (ò gliceròl segon son nom usuau), exemple de molecula amb de grops alcòls que son lei foncions principalas
-
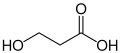
acid 3-idroxipropanoïc, exemple de molecula amb un grop alcòl qu'es pas la foncion principala
Noms usuaus[modificar | Modificar lo còdi]
Coma totei lei substàncias quimicas ancianas ò d'usatge frequent, leis alcòls pus utilizats an de noms usuaus diferents dau nom previst per lei règlas de nomenclatura. Per exemple, es lo cas dau tert-butanòl, fòrça utilizat per la fabricacion de carburant, que son nom vertadier es 2-metilpropan-2-òl.
| Tipe | Formula | Nom IUPAC | Noms usuaus |
|---|---|---|---|
| Alcòls monoidrics |
CH3OH | Metanòl | Alcòl de fusta Esperit de fusta[18] |
| C2H5OH | Etanòl | Alcòl Alcòl etilic | |
| C3H7OH | Propan-2-òl | Alcòl isopropilic Isopropanòl[19] | |
| C4H9OH | Butan-1-òl | Butanòl Alcòl butilic[20] | |
| C5H11OH | Pentan-1-òl | Pentanòl Alcòl amilic (primar)[21] | |
| C16H33OH | Exadecan-1-òl | Alcòl cetilic | |
| Alcòls poliidrics |
C2H4(OH)sub>2 | Etan-1,2-diòl | Etilèn glicòl |
| C3H6(OH)sub>2 | Propan-1,2-diòl | Propilèn glicòl[22] | |
| C3H5(OH)sub>3 | Propan-1,2,3-triòl | Gliceròl | |
| C4}H6(OH)sub>4 | Butan-1,2,3,4-tetraòl | Eritritòl | |
| C5H7(OH)sub>5 | Pentan-1,2,3,4,5-pentòl | Xilitòl | |
| C6H8(OH)sub>6 | Exan-1,2,3,4,5,6-exòl | Mannitòl Sorbitòl | |
| C7H9(OH)7 | Eptan-1,2,3,4,5,6,7-eptòl | Volemitòl | |
| Alcòls alifatics insaturats |
C3H5OH | Prop-2-èn-1-òl | Alcòl alilic |
| C10H17OH | 3,7-dimetilocta-2,6-dièn-1-òl | Geraniòl | |
| C3H3OH | Prop-2-in-1-òl | Alcòp propargilic | |
| Alcòls aliciclics |
C6H6(OH)6 | Cicloexan-1,2,3,4,5,6-exòl | Inositòl |
| C10H19OH | 5-metil-2-(propan-2-il)cicloexan-1-òl | Menthol |
Produccion[modificar | Modificar lo còdi]
Procès Ziegler e oxo[modificar | Modificar lo còdi]
Lo procès Ziegler permet de produrre d'alcòls linears a partir d'una reaccion entre l'etilèn e lo trietilalumini seguida per una oxidacion e una idrolisi[23]. Aquò entraïna la sintèsi de divèrseis alcòls que son separats per destillacion. Un exemple de sintèsi de l'octanòl segon aqueu procès es lo seguent :
- Al(C2H5)3 + 9 C2H4 → Al(C8H17)3
- Al(C8H17)3 + 3 O + 3 H2O → 3 HOC8H17 + Al(OH)3
Per sintetizar d'alcòls pus importants, es possible d'utilizar l'idroformilacion deis alcèns seguida per una etapa d'idrogenacion. Per exemple :
- RCH=CH2 + H2 + CO → RCH2CH2CHO
- RCH2CH2CHO + 3 H2 → RCH2CH2CH2OH
En particular, aqueu procès permet de produrre d'alcòls gras que son utilizats per la fabricacion de detergents.
Reaccions d'idradatacion[modificar | Modificar lo còdi]
Certaneis alcòls leugiers fòrça utilizats dins l'industria (etanòl, isopropanòl, 2-butanòl, tert-butanòl) son fabricats amb una addicion d'aiga sus d'alcèns. Existís dos metòdes per o far :
- lo metòde dirècte utiliza de catalisaires per defugir la necessitat de formar d'un intermediari estable. A l'avantatge d'utilizar d'alcèns eissits de la petroquimia.
- lo metòde indirècte transforma l'alcèn en un estèr sofrat avans de l'idrolizar.
Procès biologics[modificar | Modificar lo còdi]
Certaneis alcòls pòdon èsser produchs per de procès biologics. En particular, es lo cas de l'etanòl que pòu èsser sintetizat per fermentacion per de levuras transformant de sucres. Aqueu procès es fòrça conegut dins leis industrias fabricant de beures alcoolizats coma lo vin ò la bièra. Pasmens, es possible de produrre d'autreis alcòls d'un biais industriau a partir d'autrei procès de fermentacion. Per exemple, es lo cas dau butanòl que pòu èsser sintetizat per lo bactèri Clostridium acetobutylicum a partir de la cellulòsa[24].
Reaccion de substitucion[modificar | Modificar lo còdi]
Es possible de produrre d'alcòls a partir de reaccion de substitucion nucleofila entre un alogenoalcan e una basa fòrta dau tipe NaOH ò KOH. Leis alogenoalcans de classa I permèton d'obtenir d'alcòls de classa I e, respectivament, leis alogenoalcans II e III dònan la possibilitat de sintetizar d'alcòls II e III. La sintèsi d'alcòls II e III es eglament possibla gràcias a una reaccion entre un reactiu de Grignard e un grop carbonil R(CO)R' (reaccion de Grignard), entre un alogenoalcan e un grop carbonil en preséncia d'un metau (reaccion de Barbier) ò entre un alogenoalcan e un grop carbonil en preséncia de saus de cròme ò de niquèl (reaccion de Nozaki–Hiyama).
Reaccion de reduccion[modificar | Modificar lo còdi]
Existís au mens tres reaccions de reduccion que permèton de sintetizar d'alcòls. La premiera consistís a redurre una cetona ò un aldeïd amb un agent reductor coma lo tetraidruroborat de sòdi ò lo tetraidruroaluminat de liti. Es tanben possible d'utilizar la reduccion de Meerwein-Ponndorf-Verley qu'es basada sus la reduccion d'un alcòl, catalizada per un alcoolat, per formar un autre alcòl. De mai, dins un mitan reaccionau oxidant, aquela reaccion es reversibla, çò que permet de tornar obtenir lo premier alcòl. Enfin, se fau mencionar l'idrogenacion asimetrica de Noyori que permet de fabricar un alcòl a partir d'un β-ceto-estèr.
Idrolisi[modificar | Modificar lo còdi]
En preséncia d'acid sulfuric, es possible d'obtenir d'alcòls a partir d'alcèns segon una reaccion d'idratacion. Aquò permet la sintèsi d'alcòls segondaris ò terciaris. Pasmens, l'utilizacion d'acid sulfuric coma catalisaire es de còps problematica en causa de la reactivitat d'aqueu compausat. Ansin, dins certanei cas, l'utilizacion de tetraidruroborat de sòdi es donc preferida.

Proprietats generalas[modificar | Modificar lo còdi]
Proprietats fisicoquimicas[modificar | Modificar lo còdi]
Leis alcòls forman un grop important de substàncias relativament diferentas. Pasmens, quauquei ponchs comuns pòdon s'observar. Ansin, leis alcòls de massa moleculara febla son sovent liquids e incolòrs dins lei condicions normalas de temperatura e de pression[25]. Leis alcòls pus pesucs se presentan sovent sota la forma de solids blancs.
Au nivèu moleculara, lo grop –OH entraïna sovent la formacion d'un liame polar en causa de sa geometria (de tipe AX2E2) e deis electronegativitats respectivas de l'oxigèn, dau carbòni e de l'idrogèn. Aquelei grops pòdon formar de liames idrogèns. Aquò a de consequéncias sus lo ponch d'ebulicion (sovent auts) e la solubilitat dins l'aiga. Dins aquò, aquelei darriera varia egalament segon d'autrei paramètres coma la talha de la molecula (la solubilitat aumenta se la talha demenís), lo nombre de foncions alcòl (lei diòls son pus solubles que leis alcòls simples) e la ramificacion de la cadena carbonada (la ramificacion aumenta la solubilitat).
-
Isopropanòl, exemple d'alcòl simple liquid dins lei condicions fisicoquimicas de la vida vidanta
-
Polidocanòl, exemple d'alcòl gras e lòng que fòrma un solid blanc dins lei condicions normalas de pression e de temperatura
Reactivitat[modificar | Modificar lo còdi]
Aciditat[modificar | Modificar lo còdi]
La polarizacion fòrta dau liame O–H ofrís la possibilitat d'una rompedura ionica[26]. Leis alcòls constituïsson d'acids febles amb un pKa generau situat entre 16 e 18 dins l'aiga (10 per lei fenòls) gràcias a la liberacion d'un cation H+. Aquela aciditat es donc fòrça febla e sa manifestacion dins un mitan aquós es donc fòrça limitada. En revènge, es possible de l'observar dins de solucions non aquosas, generalament gràcias a l'accion d'una basa fòrta coma l'amidur de sòdi. La basa conjugada d'un alcòl es un ion alcoolat.
Un alcòl es egalament una basa indiferenta se se considera la capacitat dei doblets liures de l'atòm d'oxigèn de capturar un proton per formar l'acid ROH2+. Dins aquò, lo pKa d'un tau acid es d'aperaquí -2 e sa formacion es donc fòrça febla en mitan aquós. Enfin, gràcias a la reactivitat dei doblets, se pòu considerar l'alcòl coma una basa de Lewis.
Nucleofilia[modificar | Modificar lo còdi]
Leis alcòls son de nucleofils bòns en causa de la reactivitat dei doblets liures de l'oxigèn. Pasmens, aquela proprietat a de limits car la rompedura de la liason C–O es pas totjorn possibla.
Nucleofugacitat[modificar | Modificar lo còdi]
La polarizacion dau liame C–O entraïna l'aparicion d'una rompedura ionica segon l'esquèma R–OH → R+ + HO-. Aquela rompedura es pasmens relativament malaisada e leis alcòls son de nucleofugs marrits. Dins aquò, es possible de la facilitar se l'alcòl es estat protonat per avans (ROH2+). Aquela proprietat permet ais alcòls de participar a de reaccions de substitucion nucleofila ò d'eliminacion[27].
Reaccions[modificar | Modificar lo còdi]
Deprotonacion[modificar | Modificar lo còdi]
La deprotonacion d'un alcòl es una reaccion acidobasica qu'implica l'atòm d'idrogèn dau grop –OH. Amb un pKa de 16 a 18, es possible de l'arrancar gràcias a l'accion d'una basa fòrta coma l'idrur de sòdi. Aquò permet de formar d'ions alcoolat.
Substitucion nucleofila[modificar | Modificar lo còdi]
Leis alcòls amb un grop –OH participan pauc ai reaccions de substitucion nucleofila car aqueu grop es ben estacat au rèsta de la molecula. Per permetre una tala reaccion, es necessari de protonar lo grop –OH per formar –OH2+. Dins aqueu cas, la partença dau grop alcòl entraïna la formacion d'una molecula d'aiga, substància establa, e la substitucion nucleofila es possibla.
L'interès principau d'una substitucion nucleofila menada sus un alcòl es de remplaçar la foncion –OH per un atòm d'alogèn coma lo clòr ò lo bròme. L'apondon de catalisaires (acid cloridric) es sovent requista.
Un cas particular de substitucion nucleofila es la desoxigenacion de Barton–McCombie. Permet de transformar un alcòl en alcan gràcias a l'accion d'un tioestèr seguit per una reaccion amb un organostannic e un organoborat.
Desidratacion[modificar | Modificar lo còdi]
Es possible de desidratar un alcòl gràcias a l'accion d'un acid fòrt[28]. D'efiech, lei proprietats de basa de Lewis dei doblets liures de l'atòm d'oxigèn pòdon li permetre de capturar un ion H+. Dins aqueu cas, aquò pòu menar a la formacion d'una molecula d'aiga que quita lo rèsta de la molecula. Aqueu fenomèn es relativament simple amb leis alcòls terciaris mai es pus malaisat amb leis alcòls primaris. Mena generalament a una reaccion d'eliminacion que permet de sintetizar un alcèn. Dins lo cas onte la formacion de plusors alcèns diferents es possibla, lo produch majoritari es generalament aqueu previst per la règla de Zaitsev.

Esterificacion[modificar | Modificar lo còdi]
Leis alcòls e leis acids carboxilics pòdon reagir per formar un estèr (esterificacion de Fischer[29]). Aquela reaccion necessita generalament un catalisaire coma l'acid sulfuric :
Oxidacion[modificar | Modificar lo còdi]
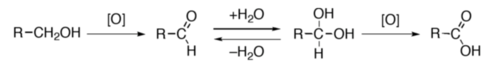
Leis alcòls primaris (R–CH2–OH) pòdon èsser oxidats per formar d'aldeïds ò d'acids carboxilics. Dins aqueu procès, l'aldeïd es generalament una etapa avans l'obtencion de l'acid. Pasmens, es possible de limitar l'oxidacion a la sintèsi de l'aldeïd (per exemple en utilizant lo reactiu de Collins[30]) ò de formar dirèctament l'acid carboxilic (amb un oxidant poderós coma lo permanganat de pòtassi ò lo reactiu de Jones)[31]. Leis alcòls segondaris (R1R2CH–OH) pòdon èsser oxidats per formar de cetonas. En revènge, leis alcòls terciaris son resistents a l'oxidacion[32].
Aplicacions e utilizacions[modificar | Modificar lo còdi]
Leis alcòls son fòrça utilizats dempuei la descubèrta dau procès de fermentacion, benlèu tre lo periòde finau de la Preïstòria. Pasmens, seis usatges conoguèron un desvolopament important amb lo progrès tecnic iniciat per la Revolucion Industriala. Uei, pòdon èsser gropats au sen de quatre ensembles distints :
- lei solvents coma l'etanòl, pauc toxic, qu'es utilizat per fabricar de perfums ò de medicaments.
- lei combustibles coma lo metanòl e l'etanòl que pòdon remplaçar de combustibles fossils.
- lei reactius que son fòrça utilizats en quimia organica.
- lei antigèus que son basats sus la temperatura de solidificacion bassa de certaneis alcòls coma l'etilèn glicòl.
Certaneis alcòls son produchs en quantitats fòrça importantas amb, per exemple, mai de 20 milions de tonas anualas per lo metanòl durant leis ans 2010[33].
Toxicitat[modificar | Modificar lo còdi]
L'etanòl es una substància toxica ben coneguda que pòu entraïnar la mòrt s'es consumada en quantitat importanta. Sa consumacion repetida a tanben de consequéncias negativas sus la santat umana car favoriza l'aparicion de malautiás grèvas coma de cancèrs[34]. Pasmens, l'etanòl fa partida deis alcòls mens toxics per l'òme. D'efiech, la màger part deis autreis alcòls presentan una toxicitat importanta[35] en causa d'una durada d'eliminacion relativament lònga, de procès d'eliminacion entraïnant de degalhs dins lei rens e d'efiechs toxics dirèctes ò indirèctes amb l'aparicion de substàncias toxicas durant lei procès de degradacion menats per l'organisme[36][37].
Annèxas[modificar | Modificar lo còdi]
Liames intèrnes[modificar | Modificar lo còdi]
Bibliografia[modificar | Modificar lo còdi]
- (fr) Institut national de recherche et de sécurité, « Les alcools », Fiche solvants ED4225, novembre de 2009.
- (fr) Christian Bellec, Chimie organique, De Boeck supérieur, 2017.
- (de) Hermann Kolbe, Ueber den natürlichen Zusammenhang der organischen mit den unorganischen Verbindungen, die wissenschaftliche Grundlage zu einer naturgemässen Classification der organischen chemischen Körper, publicat en 1859, edicion per von Ernst von Meyer, Leipzig, Ostwalds Klassiker n° 92, 1897.
- (fr) Élisabeth Le Masne de Chermont, Cours de chimie, Heures de France, 1998.
- (fr) Pierre de Menten e Pierre de Menten de Horne, Dictionnaire de chimie. Une approche étymologique et historique, De Boeck Supérieur, 2013.
- (fr) Paul Schützenberger, Traité de chimie générale comprenant les principales applications de la chimie aux sciences biologiques et aux arts industriels · Volume 3, Hachette, 1883, pp. 130-186.
Nòtas e referéncias[modificar | Modificar lo còdi]
- ↑ Lo congrès permanent de la lenga occitana, Dicod'Òc, cèrca « alcool », 4 de setembre de 2020, [1]
- ↑ (en) IUPAC, Compendium of Chemical Terminology, 2a ed., article « alcohol ».
- ↑ (en) P. E. McGovern, J. Zhang et al., « Fermented beverages of pre- and proto-historic China », Proc. Natl. Acad. Sci. USA, vol. 101, n° 51, 2004, pp. 17593-17598.
- ↑ D'efiech, lei alquimistas arabopersans de l'Edat Mejana destinavan sei descubèrtas a un public chausit car l'art alquimic, destinat a descubrir e contemplar l'òbra divina, èra reservat a un elèit capable de mestrejar un tau saber. Ansin, lei tèxtes èran generalament codats amb un contengut pauc clar unicament comprensible per leis iniciats e per lei discípols dau mèstre. Aquò ne'n facilitèt donc pas totjorn la difusion e la comprenença.
- ↑ (en) R. J. Forbes, A Short History of the Art of Distillation : From the Beginnings Up to the Death of Cellier Blumenthal, Brill, 1970, 2a ed., p. 89.
- ↑ (en) Robert Boyle, The Sceptical Chymist, J. Cadwell, 1661, pp. 192–195.
- ↑ (en) A. S. Couper, « On a New Chemical Theory », Philos. Mag., vol. 16, 1858, pp. 104-116.
- ↑ (en) Smiljko Asperger, Chemical Kinetics and Inorganic Reaction Mechanisms, Springer US, 2011, p. 34.
- ↑ (fr) Paul Depovere, Chimie organique, De Boeck Supérieur, 2005, p. 59.
- ↑ (en) Klaus Noweck e Wolfgang Grafahrend, « Fatty Alcohols », Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, 2006.
- ↑ (en) Zerong Wang, « Ziegler Alcohol Synthesis (Ziegler Higher Alcohol Synthesis, Alfol Process, Ziegler-Alfol Process, Ziegler-Alfol Synthesis) », Comprehensive Organic Name Reactions and Reagents, John Wiley & Sons, 2010.
- ↑ (fr) Paul Schützenberger, Traité de chimie générale comprenant les principales applications de la chimie aux sciences biologiques et aux arts industriels · Volume 3, Hachette, 1883, p. 130.
- ↑ (de) Heinrich Zimmerc, Akkadische Fremdwörter als Beweis für babylonischen Kultureinfluss, 1915, Leipzig, A. Edelmann, 1915, p. 61.
- ↑ (fr) Julien Calafell, Benoît Champin, Blandine Durand, Denise Nogue, Jean-Baptiste Rota e Denis Vivares, Exos Résolus - Prépas Chimie PCSI, Hachette Éducation, 2015, p. 259.
- ↑ 15,0 et 15,1 (fr) Christian Bellec, Chimie organique, De Boeck supérieur, 2017, p. 211.
- ↑ (fr) Élisabeth Le Masne de Chermont, Cours de chimie, Heures de France, 1998, p. 134.
- ↑ (fr) Jean Rigaudy, Nomenclature des Composés Organiques, Ed. Techniques Ingénieur, 1987, p. K220-15.
- ↑ (fr) Paul Karrer, Traité de chimie organique, Editions du Griffon, 1948, p. 85.
- ↑ (fr) Institut national de recherche et de sécurité, « Propan-2-ol. Fiche toxicologique n° 66 », Base de données Fiches toxicologiques, consultada lo 31 d'aost de 2023.
- ↑ (fr) Institut national de recherche et de sécurité, « Butan-1-ol. Fiche toxicologique n° 80 », Base de données Fiches toxicologiques, consultada lo 31 d'aost de 2023.
- ↑ (fr) Institut national de recherche et de sécurité, « Pentanols. Fiche toxicologique n° 206 », Base de données Fiches toxicologiques, consultada lo 31 d'aost de 2023.
- ↑ (fr) Institut national de recherche et de sécurité, « Propylène-glycol. Fiche toxicologique n° 226 », Base de données Fiches toxicologiques, consultada lo 31 d'aost de 2023.
- ↑ (en) Jürgen Falbe, Helmut Bahrmann, Wolfgang Lipps, Dieter Mayer, article « Alcohols, Aliphatic », Ullmann's Encyclopedia of Industrial Chemistry, 6a edicion, 2002.
- ↑ (en) W. Zverlov, O. Berezina, GA. Velikodvorskaya, WH. Schwarz, "Bacterial acetone and butanol production by industrial fermentation in the Soviet Union: use of hydrolyzed agricultural waste for biorefinery", Applied Microbiology and Biotechnology, 2006, 71 (5) : 587–97.
- ↑ (fr) Élisabeth Le Masne de Chermont, Cours de chimie, Heures de France, 1998, p. 135.
- ↑ (fr) Christian Bellec, Chimie organique, De Boeck supérieur, 2017, pp. 211-214.
- ↑ (fr) Christian Bellec, Chimie organique, De Boeck supérieur, 2017, pp. 213-214.
- ↑ (fr) Christian Bellec, Chimie organique, De Boeck supérieur, 2017, pp. 214-218.
- ↑ (fr) Jacques Maddaluno, Véronique Bellosta, Isabelle Chataigner, François Couty, Anne Harrison-Marchand, Marie-Claire Lasne, Jacques Rouden, Chrystel Lopin-Bon e Ludivine Garcia, Le cours de chimie organique, Dunod, 4a edicion, 2023, p. 350.
- ↑ (fr) Christian Bellec, Chimie organique, De Boeck supérieur, 2017, p. 230.
- ↑ (en) Marcos Fernández e Gabriel Tojo, Oxidation of Primary Alcohols to Carboxylic Acids: A Guide to Current Common Practice (Basic Reactions in Organic Synthesis), Berlin, Springer, 2006.
- ↑ (fr) Christian Bellec, Chimie organique, De Boeck supérieur, 2017, p. 230.
- ↑ (en) E. Fiedler, G. Grossmann, D. Burkhard Kersebohm, G. Weiss e C. Witte, « Methanol », Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, 2005.
- ↑ (fr) Institut national de recherche et de sécurité, « Éthanol. Fiche toxicologique n°48 », Base de données Fiches toxicologiques, consultada lo 30 d'aost de 2023.
- ↑ Lor ingestion es sovent considerada coma una urgéncia medicala.
- ↑ Per exemple, lo metanòl es transformat dins lo fetge en formaldeïd qu'es una substància fòrça toxica per l'organisme.
- ↑ (fr) Institut national de recherche et de sécurité, « Les alcools », Fiche solvants ED4225, novembre de 2009.